
世纪之交抗体药物成为备受业界关注的领域。近年抗体偶联药物(ADC)、双特异性抗体(BsAb)和免疫检查点抑制剂成为抗体领域热议的话题,免疫检查点抑制剂PD-1因临床疗效显著,国内超百家企业快速跟进布局研发。2019年ADC药物经历了10年低谷期之后首次一年中有3个新药连续获批。2020年上半年,美国FDA又批准Trodelvy上市,中国ADC药物赫塞莱、安适利也先后获得批准,业内人士称“ADC药物的春天来了”。2006年全球首次靶向PD-1单克隆抗体开展临床研究,经过十余年的发展,迄今为止我国已有8个PD-1/PD-L1肿瘤免疫疗法单克隆抗体获准上市。近年随着PD-1/PD-L1研究的热潮,BsAb药物的开发也趁热打铁。

近日,第30期science café在浦东国际人才港成功举办,本期活动特邀中国科学院上海药物研究所沈竞康研究员及嘉和生物药业周新华博士为大家解读抗体偶联药物和双特异性抗体药物的全球研发现状及未来前景与挑战。


两位嘉宾在现场做报告(左:沈竞康、右:周新华)
以下是嘉宾报告分享的精彩内容
ADC药物成功上市顺应新药发展趋势,填补临床需求空白
中国经历了十几年的药物创新探索,药物研究工作者瞄准国际医药科学、产业发展趋势,发展前沿创新技术,研究开发具有重要临床价值的新药,取得了卓著的进步。我国新药研发正在悄然发生由知识产权、新药证书为导向的创新,向满足临床需求为目标的创新转变。
抗体偶联药物(ADC)是本世纪以来取得重要的技术突破,成功研发的一类新型靶向抗肿瘤药物,其由单克隆抗体(mab)、化学连接子(Linker)、强毒性药物(payload)组成。ADC与小分子抗肿瘤药物相比提高了靶向性和安全性;与单克隆抗体相比,显著增强对肿瘤细胞的杀伤能力,从而提高了有效性,被称为“生物导弹”。ADC药物的作用机理是其首先通过抗体精准靶向,特异性结合于细胞表面抗原,随后通过内吞作用将ADC药物带入到细胞内,而后在溶酶体作用下,经特定机理裂解或经抗体降解释放出强毒性小分子药物在细胞质内发挥杀灭肿瘤细胞的作用,如图1。
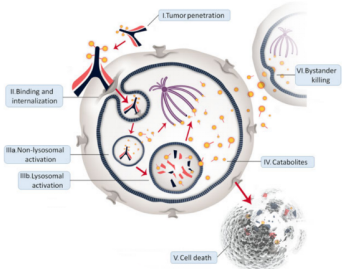
图1 ADC药物的作用机制
靶向治疗这一概念是1913年德国科学家Paul Ehrlich提出的,按照该种设想获得的药物被称为“神奇的子弹”。这个“神奇的子弹”随着单克隆抗体应用于临床才得以实现。如图2所示,早期的ADC药物中抗体多为鼠抗,药物多为临床应用的细胞毒类抗肿瘤药,因鼠抗的免疫源性问题和小分子活力不够强,一直以来没有好的临床结果。直至2000年FDA批准了第一个ADC药物Mylotarg,标志着ADC药物研发首次成功,至今美国FDA批准上市的ADC药物共有9个,如图3。现阶段全球共800多种抗体,其中成药的有70至80种,开展ADC药物临床研究数百项,其中比较集中的涉及20多个靶点。
自2011年首个第二代ADC药物Adcetris上市以来,ADC药物即成为了行业研发的热点,近十年ADC药物进入临床阶段的数量以每年超15%的速率递增。但这十年中,ADC药物研发也受到了其他技术创新的冲击,如肿瘤免疫治疗、细胞治疗CAR-T。直至近两年,ADC新药历经正常的临床周期连续获批,ADC药物再度受到关注。ADC药物的再度回归归功于临床需求的精准定位,与临床病患的精准对接。中国近年新药审评审批制度改革,促使进口药品进入中国市场的速度越来越快,从而使得中国本土制药企业研发的同类型新药抢注时间逐渐缩短,中国现阶段除了罗氏的赫塞来和武田的安适利已获批上市外,另有22个ADC新药处于临床研发阶段,共涉及到20家企业,如图4,其中百奥泰的BAT8001已进入临床三期,荣昌生物的RC48进入临床二期,近期科伦制药靶向TROP2的ADC新药SKB264同时申请中美临床试验。
2000年上市的Mylotarg是第一代ADC药物,其通过赖氨酸残基偶联,具有随机偶联、酸敏感、可裂解的特性,但稳定性相对较差。第二代ADC药物通过赖氨酸残基或半胱氨酸残基偶联,如Kadcyla为赖氨酸残基随机偶联,不可裂解的特性使linker稳定性显著改善,细胞内抗体降解后释放出药物;Adcetris为半胱氨酸残基偶联,可裂解的linker在溶酶体酶作用下释放药物,不仅提高了稳定性,且在细胞内有效释放药物,从而提高疗效,降低毒副作用。
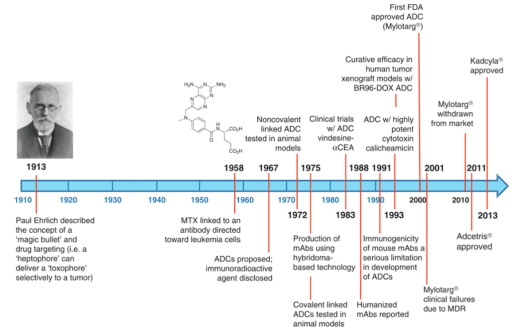
图2 ADC药物发现历程
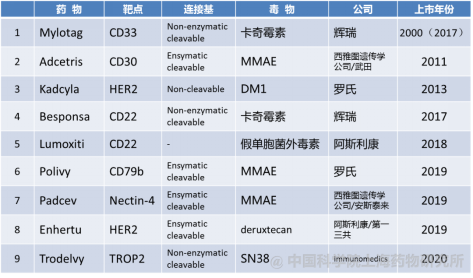
图3 FDA批准上市的ADC药物
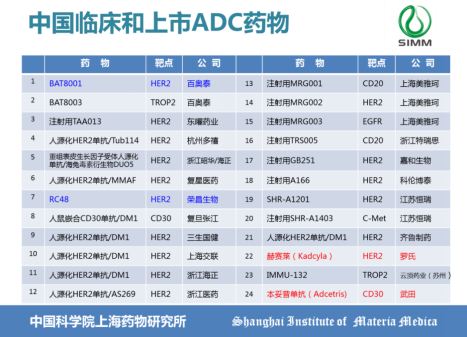
图4 中国临床和上市ADC药物
抗原的特异性、抗体的亲和力和内吞率、以及药物的毒性和偶联剂的稳定均一性是ADC药物的4个关键技术
ADC药物研发的关键技术与抗原、抗体、药物、以及偶联剂有关。
首先是抗原,抗原的特异性关系到ADC药物靶点的选择性,抗原需具有差异性、可及性和有效性三个特点。差异性是指抗原在肿瘤细胞中高表达,而正常细胞中低表达,差异性越高ADC药物选择性越好,Kadcyla药物就具有较高的抗原差异性。可及性在于细胞表面抗原是否高表达,表达量越高,可及性指数越高,ADC药物的选择性越好。ADC药物在血液瘤研究中成功率较高,实体瘤成功率相对较差,是药物可及性的另一侧面,实体瘤需要药物有效穿透组织。有效性则与良好的内吞效率关系十分密切,内吞效率因抗原、抗体的性质各异。
抗体需具备靶标特异性和高亲和力,理想的代谢稳定性和内吞效率,并且兼顾低免疫原性,以及低交叉反应性和适当的链接绑定属性等。药物是发挥药效的关键,由于抗体载荷的药物分子数受到限制,需具备高效特性,现阶段用于偶联药物主要是微管抑制剂、作用于DNA和拓扑异构酶I抑制剂三类。
偶联剂的性质不仅决定ADC药物在循环过程中的稳定性,还影响药物在肿瘤组织、细胞中的有效释放;另一方面偶联方式影响ADC药物的均一性和质量控制,通常一个单克隆抗体有76-92个赖氨酸,平均每个抗体偶联3.5-4.0个小分子药物,其可能的异构体是一个天文数字,导致大部分ADC是一个复杂的多元混合物,结果不均一,对工艺是极大的挑战。同时,偶联剂需具有较高稳定性,从而降低脱靶率和毒副作用。
ADC药物未来发展趋势是提高ADC的均一性、扩大治疗窗
ADC药物未来主要的发展趋势主要集中在提高均一性,扩大治疗窗的研究。提高均一性有三种手段:第一,生物技术手段,定点引进非天然氨基酸,但引入非天然氨基酸技术的表达水平和工艺制造还面临挑战。第二,化学定点偶联,如桥链化学定点交联。现阶段上海新理念生物医药、polytherics、IGENICA等公司开发了此种偶联技术。第三,化学-生物结合的定点偶联,如Synaffix公司的糖苷链接技术GlycoConnect™和双弹头技术HydraSpace™。除此之外,ADC药物研发仍然面临着挑战,如脱靶毒性问题,实体瘤的物理渗透性,以及毒性机理和天然/获得性耐药机理研究。ADC药物未来的机遇是ADC的定点偶联,非经典细胞毒性payload扩大安全窗,新的偶联方式和药物释放方式的有效递送,再者针对肿瘤异质性拓展靶标等。
老靶点新分子的研发仍然是企业布局生物药的主要策略,双特异性抗体在全球抗体药物中优势突显
生物药的开发过程中,最关键的阶段是临床研究,周期长,成本高,且研究成败不确定,早期研发占总成本的10%,工艺和CMC占10%,而临床阶段占80%。中国因研发资金不足,人才累计不够,现阶段追求新靶点新分子开发的时机尚不成熟,而 “4+7”带量采购政策,以及在全球biosimilar降到了原研药成本的10%-15%的大背景下,市场竞争更加激烈,企业追求老靶点老分子的研发更加艰难,因此中国大多数企业研发管线布局聚焦在老靶点新分子的开发,如图5。
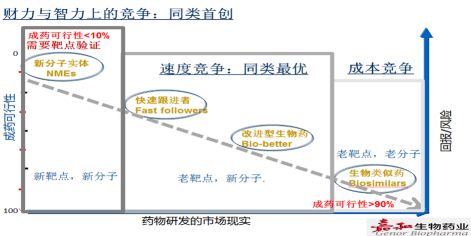
图5 药物研发市场分布图
中国人口寿命处于全球第三梯队国家,寿命平均76岁,近年的有效医疗手段,有望使得癌症由缺医少药的急性病转为慢性病,而5年的生存期可使中国人口寿命平均可延长至81岁,与第一梯队国家并肩。肿瘤转为可控的慢性病的依据是有一系列的有效治疗手段,如体内输入异体NK 细胞,杀伤肿瘤细胞,同时调动T细胞的活性,如图6,为免疫系统提供“车辆”;通过融瘤病毒或个性化肿瘤疫苗释放新抗原,为免疫系统“加油”;PD-1抗体可释放免疫系统“刹车”,CTLA-4抗体则通过清除Treg进一步“释放刹车”3,这一系列有效的治疗手段可使得绝大多数癌症5年内转变成慢性病。
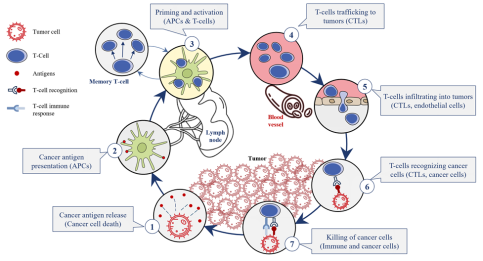
图6 肿瘤免疫治疗通路
新型生物药中,新靶点的抗体药或小分子药的研发,靶点验证时间长,研发新分子的速度慢,而CART或NK等免疫细胞疗法成本高(年治疗费用高达几十万美金),同时现有单克隆抗体药物存在好靶点难寻、药物高剂量、生产工艺高成本等问题,因此开发双特异性抗体药物的优势突显,如图7。双特异性抗体的优势具体有以下几点:第一,可绕开单克隆抗体对已验证的优秀靶点的惨烈竞争,研发产品可专利;第二,可定量设计双靶点抗体;第三,在药效和毒性等生物学方面可争取叠加优势;第四、因药效可叠加,剂量较低,从而可降低生产成本,第五可有机会采用合适的方法筛选到BIC(Best in class),第六,可以开发成皮下注射制剂等。
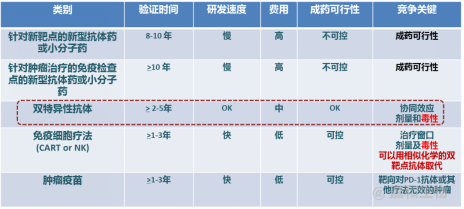
图7 各种生物药的优劣对比
生物学协同性、毒性、可生产性和免疫原性是双特异性抗体设计四要素
进入临床研究的理想双抗分子需要满足四个要素,包括生物学协同性、毒性、可生产性和免疫原性。其中生物学协同性包括对临床疗效及合理的药代动力学的考量,协同性越好,药物的剂量越低;毒性与剂量选择灵活度有关,毒性越低剂量越灵活;可生产性主要从理化特性和生产性的考量;免疫原性问题考虑尽量避免长期治疗后产生的免疫原性。
就双特异性抗体的靶点选择问题,全球双特异性抗体在研的联合靶点有哪些,如图8,与CD3靶点连接的药物最多,其次是HER2、EGFR、CD47、4-1BP、PD-L1等,圈越大表示与该靶点连接的药物越多,线条的粗细表示连接的两个靶点的双靶点药物最多。
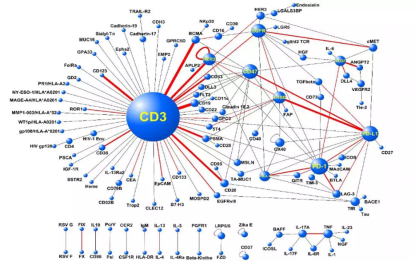
图8 全球BsAb的在研靶点分布图
双特异性抗体全球竞争激烈,主要聚焦肿瘤领域,
不对称IgG双抗优势显著
双特异性抗体药物是全球抗体药物中竞争最激烈的技术之一,现阶段全球双特异性抗体的治疗领域主要包括:抗肿瘤,抗炎和其他类疾病,其中抗肿瘤双抗最多,涉及5种作用机制,包括抗血管生成、抗肿瘤生成、增强抗肿瘤免疫、调节肿瘤微环境、靶向肿瘤细胞的清除。其次是自身免疫系统疾病。其他类疾病如血友病、眼部疾病、神经疾病、红斑狼疮等。
现阶段双特异性抗体按结构划分为三类:非IgG样,对称IgG样,不对称IgG样。其中不对称IgG样设计开发难度最大,技术路线长,设计工艺难度大,但其解决了knob-into-hole技术在common light chain方面的瓶颈问题,优势最显著。
现阶全球双特异性抗体研究领先企业是Amgen,有16个药处于临床到上市阶段,临床前也有60多个项目,其次是Roche,有13个药处于临床到上市阶段,近年研发推进较快。中国研发最强企业要属康宁杰瑞、百济神州、信达、友芝友等,如图9,百济神州临床项目最多,12个处于临床在研阶段。嘉和生物的双特异性抗体项目主要聚焦于不对称的双靶点抗体;用CAAD技术定量调节生物靶点活性及CD3毒性确定其BsAb的成药性,现有BsAb共有6个分子处于快速推进中。
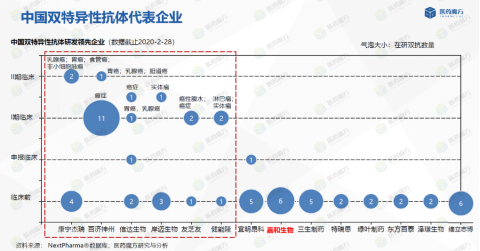
图9 中国双特异性抗体代表企业(来源:医药魔方)